El análisis de compuestos polares mediante cromatografía líquida de alta resolución ha supuesto siempre un desafío debido a su escasa retención en las fases estacionarias de fase reversa que son las más ampliamente utilizadas en los laboratorios. Para conseguir una mayor retención de estos compuestos en fase reversa se ha recurrido a utilizar aditivos en las fases móviles (cromatografía de par iónico) o a su derivatización para disminuir su polaridad. También se han utilizado otras fases estacionarias con grupos funcionales con carga (cromatografía de intercambio iónico) o incluso al uso de HPLC en fase normal.
Más recientemente, la Cromatografía de Interacción Hidrofílica o HILIC se ha ido posicionando como una alternativa muy interesante para el análisis de estas moléculas por HPLC, demostrando una reducción significativa de los costes y una mayor eficiencia en la separación con la ventaja además de que esta técnica permite separar compuestos muy polares utilizando el mismo sistema y disolventes que la HPLC de fase reversa (RPLC).
Sin embargo, a pesar de que la cromatografía HILIC se ha afianzado como una técnica potente y efectiva para casos difíciles de separación de compuestos, también presenta ciertos problemas como la mala reproducibilidad y las dificultades a la hora de solubilizar las muestras y los aditivos utilizados en las fases móviles con alto contenido de disolvente orgánico. Debido a ello, el desarrollo de métodos analíticos HILIC requiere conocer muy bien las particularidades de la técnica y sus diferencias con respecto a la cromatografía de fase reversa.
HILIC: una técnica en crecimiento
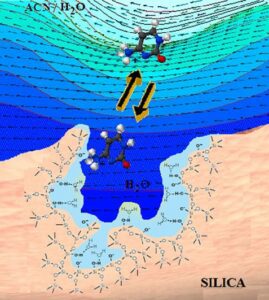
La Cromatografía de Interacción Hidrofílica, se diferencia de la cromatografía líquida de fase reversa, fundamentalmente en que se utiliza una fase estacionaria polar e hidrofílica La fase móvil, por su parte, es de naturaleza altamente orgánica (más del 60% de solvente, típicamente acetonitrilo) que contiene un pequeño porcentaje de solvente acuoso o tampón, así como cualquier otro solvente polar. Esta combinación, permite que la fase móvil forme una capa rica en agua adsorbida a la superficie polar de la fase estacionaria.
En este contexto, los analitos polares – sustancias con afinidad por el agua – tenderán a distribuirse por esa capa de la fase estacionaria, reteniéndose en ella debido a la combinación de diferentes tipos de mecanismos:
- Partición líquido-líquido: los analitos se distribuyen entre la capa rica en agua y la mayor parte de la fase móvil con alto contenido orgánico, dependiendo de su afinidad por cada una de las fases.
- Formación de enlaces de hidrógeno: los grupos funcionales polares de los analitos pueden formar enlaces de hidrógeno con la fase estacionaria, que contribuyen a retener los analitos.
- Interacciones electrostáticas también jugarán un papel muy importante, ya que los grupos funcionales ionizados interactuarán con cargas opuestas en la fase estacionaria, lo que contribuye a la retención de los analitos.
- Interacciones de Van der Waals
Implementación y ventajas:
Ahora bien, a la hora de implementar la técnica HILIC en el laboratorio hay que tener en cuenta una serie de procedimientos que garanticen la mejor ejecución y la elección correcta de la columna es lo primero. Como se tiene que garantizar la polaridad y el factor hidrofílico de esta fase estacionaria, la elección entre los diferentes tipos de fases estacionarias disponibles -silica, zwitterioic, amide, aminopropil…etc.) va a afectar a la selectividad del método cromatográfico, por lo que las referencias bibliográficas previas pueden ayudar a limitar la imprescindible fase de “ensayo-error”.
También será importante realizar una buena elección de la fase móvil. El solvente fuerte en este caso es el agua; el solvente débil será orgánico y necesariamente miscible con agua. El más habitual es el acetonitrilo (ACN), siendo posible añadir metanol o alcoholes para conseguir mejoras en la selectividad para determinadas aplicaciones.
Otra ventaja significativa de la HILIC es la baja contrapresión por la baja viscosidad de las fases móviles ricas en materia orgánica que resulta en tiempos de análisis más rápidos. Esto es particularmente relevante cuando se utilizan columnas con tamaño de partículas de menos de 2 micrómetros, ya que una contrapresión más baja permite el uso de flujos altos en columna. Además, el efecto de calentamiento por fricción, que puede ser perjudicial en condiciones de reversa con partículas pequeñas, no es un problema en HILIC porque la presión es generalmente 2 o 3 veces menor.
Además, HILIC permite inyectar directamente extractos en solventes orgánicos apróticos obtenidos con protocolos de “sample clean-up” en fase sólida, sin la necesidad de secado y reconstitución en la fase móvil; además permite la separación de cationes, aniones y neutros polares en una sola inyección, ofreciendo un rendimiento de espectrografía de masas igual o superior al de cromatografía líquida en fase reversa.
Cómo aplicar HILIC de forma eficiente
Sin embargo, la Cromatografía Líquida de Interacción Hidrofílica (HILIC) presenta ciertos problemas que pueden afectar su rendimiento, tales como la reproducibilidad o la dificultad de re-equilibrado. Sin embargo, cada una de esas dificultades o problemáticas pueden ser resueltos siguiente el ajuste adecuado:
- Problema: Re-equilibrado lento
Normalmente, la causa principal suele ser la falta de agua en la fase móvil, pues esta debe contener la suficiente sustancia acuosa como para renovar la capa superficial en cada carrera. Para asegurar una re-equilibración rápida, la columna no debe utilizarse en ningún momento con fase móvil que contenga menos de un 5% de agua.. - Problema: Insuficiente reproducibilidad
Los problemas con la reproducibilidad pueden derivar de tres casusas diferentes. Si el origen está en el incorrecto re-equilibrado antes de la siguiente inyección, la solución consiste en asegurar que la fase móvil tenga suficiente agua para renovar rápidamente la capa superficial en cada corrida. Si no se re-equilibra completamente, el tiempo de re-equilibrado debe ser más amplio.
Por otro lado, si el solvente de la muestra es demasiado fuerte (contenido acuoso o de alcoholes alto) y afecta a la equilibración de la columna, se deberá aumentar el contenido orgánico de los solventes de muestra y/o reducir los volúmenes de inyección. Esto ayudará a mantener la consistencia en la retención.
Si los problemas de reproducibilidad se relacionan con la interacción con sitios activos en el acero inoxidable, lo ideal es utilizar un equipo diseñado y fabricado con materiales especiales para reducir estas interacciones inespecíficas del acero, como las gamas Bio/Premier de Waters. Finalmente, si la causa del problema está relacionada con la interacción con sitios activos en el acero inoxidable del sistema, concretamente con la adherencia fácil del analito, será necesario considerar un lavado con ácido fosfórico o nítrico o bien cambiar a un sistema de HPLC inerte diseñado para minimizar interacciones inespecíficas, frecuentes en biomoléculas.
- Problema: Solubilidad de la muestra
Cuando se presentan dificultades a la hora de disolver la muestra, la causa suele recaer en el uso de los solventes orgánicos: son ideales para la cromatografía HILIC, pero también pueden ser malos solventes para sales y otros analitos polares. En estos casos, lo recomendable es diluir las muestras en acetonitrilo tanto como lo permita la solubilidad y luego reducir los volúmenes de inyección para obtener una forma de pico aceptable y con buena reproducibilidad. - Problema: Forma del pico
En problemáticas relacionadas con la forma del pico pueden aparecer hasta cuatro causas principales. En primer lugar, puede ocurrir que los picos se dividan o arrastren debido al efecto de un volumen demasiado grande de solvente fuerte (agua) en el sistema. En estos casos, la solución recaería en intentar diluir la muestra en un solvente más débil, como el acetonitrilo.
Por otro lado, es posible que las muestras lleguen a arrastrarse cuando se adhieren a sitios activos en el acero inoxidable del sistema. En esos casos, hay que recordar que, si el analito es uno de los compuestos pegajosos o “sticky”, se deberá considerar un lavado del sistema y el uso de hardware inerte.
Además, algunas fases HILIC, como la sílica, pueden tener interacciones secundarias de intercambio iónico, lo que causa una retención excesiva y un arrastre de aniones o cationes. Para evitar que este imprevisto ocurra, es recomendable cambiar a fases entrelazadas que no presenten estas interacciones secundarias.
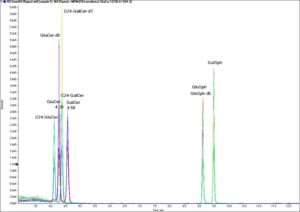
Comparación de tres columnas HILIC diferentes. Los problemas con la forma del pico pueden contaminar la información sobre el rendimiento de la separación, obviando posibles problemas en el sistema cromatográfico. Fuente: Sommella, Eduardo & Salviati, Emanuela & Musella, Simona & Di Sarno, Veronica & Gasparrini, Francesco & Campiglia, Pietro. (2020). Comparison of Online Comprehensive HILIC × RP and RP × RP with Trapping Modulation Coupled to Mass Spectrometry for Microalgae Peptidomics. Separations. 7. 25. 10.3390/separations7020025. Finalmente, el problema con la forma del pico puede tener origen en que exista una baja concentración del tampón de pH de la fase móvil. Ahora bien, aunque es cierto que añadir más tampón puede mejorar la forma del pico, hay que tener en cuenta que también puede afectar a la sensibilidad en espectrografía de masas (MS) y a la estabilidad de la línea base en ELSD y UV.
- Problema: Solubilidad del tampón
Las dificultades que puedan aparecer con la solubilidad del tampón a menudo están directamente relacionadas con que, aunque los solventes orgánicos son necesarios para retener analitos menos polares en modo HILIC, muchos de los tampones son poco solubles. Ante esta problemática, se recomienda añadir una pequeña cantidad de agua para que aumente significativamente la solubilidad del tampón en acetonitrilo. Concretamente, se recomienda añadir un 10% de agua y siempre probar la solubilidad de mezclas que contengan alta concentración de tampón con alta concentración de solvente orgánico.
HILIC en AMSbiopharma: de Esfingolípidos a Glicanos
Aunque la Cromatografía de Interacción Hidrofílica no es todavía una técnica de aplicación general, en AMSbiopharma se aplican métodos basados en esta cromatografía para biomoléculas polares. Hay dos tipos de estudios en los que resulta especialmente relevante en su acoplamiento con la detección por espectrometría de masas: los estudios de lipidómica y el análisis de metabolitos en estudios de metabolómica.
De esta forma, la experiencia en desarrollo y validación de métodos basados en cromatografía HILIC dentro de nuestros laboratorios nos permite abordar estudios con una técnica analítica de vanguardia que permite realizar separaciones cromatográficas extremadamente eficaces de biomoléculas estructuralmente muy similares, algo habitual en el estudio de biomarcadores.