En los flujos de trabajo bioanalíticos, los biomarcadores actúan como indicadores cuantificables de procesos biológicos, estados de enfermedad o respuestas terapéuticas. Sin embargo, la rápida evolución del descubrimiento de fármacos y del desarrollo clínico ha transformado los biomarcadores de simples indicadores útiles en herramientas esenciales para la toma de decisiones. Su aplicación abarca todas las etapas de la I+D farmacéutica, desde la validación temprana de dianas hasta la medición de parámetros clínicos finales, contribuyendo a cerrar la brecha entre los hallazgos de laboratorio y los resultados en pacientes. A medida que la investigación traslacional adquiere un papel cada vez más central en la innovación terapéutica, la capacidad de identificar, medir e interpretar biomarcadores en biotecnología se ha convertido en uno de los factores más determinantes para el éxito en el desarrollo de nuevos fármacos.
Este artículo analiza el papel de los biomarcadores en el bioanálisis, explora los métodos de detección y las estrategias de validación, y destaca las tendencias emergentes que están configurando su uso en la investigación traslacional y el desarrollo clínico.
¿Qué son los biomarcadores? Tipos, ejemplos y relevancia bioanalítica
Antes de examinar sus aplicaciones, es fundamental entender qué son los biomarcadores y por qué resultan útiles. Los biomarcadores son indicadores biológicos utilizados para medir procesos fisiológicos o patológicos, o respuestas a intervenciones terapéuticas. Pueden ser moléculas como proteínas, ARN, metabolitos o incluso señales digitales derivadas de dispositivos portátiles y sensores.
Los principales tipos de biomarcadores incluyen:
- Biomarcadores diagnósticos: se emplean para detectar o confirmar la presencia de una enfermedad (por ejemplo, los niveles de troponina en el infarto de miocardio).
- Biomarcadores de monitorización: permiten seguir la evolución de una enfermedad o el efecto de un tratamiento a lo largo del tiempo, como la presión arterial en la hipertensión o el colesterol LDL en la prevención cardiovascular.
- Biomarcadores farmacodinámicos o de respuesta: indican si un fármaco está actuando sobre su diana o produciendo el efecto biológico deseado, como la reducción de los niveles de glucosa tras una terapia antidiabética.
- Biomarcadores predictivos: identifican qué pacientes tienen más probabilidades de responder a un tratamiento. Por ejemplo, la expresión de HER2 en el cáncer de mama orienta la terapia con trastuzumab.
- Biomarcadores pronósticos: estiman la posible evolución o desenlace de una enfermedad con independencia del tratamiento, como ciertos perfiles genéticos que indican un comportamiento tumoral agresivo.
- Biomarcadores de seguridad: alertan sobre posibles toxicidades, como el aumento de las enzimas hepáticas que señala hepatotoxicidad.
- Biomarcadores de susceptibilidad o riesgo: revelan la predisposición a desarrollar una enfermedad antes de que aparezcan los síntomas, como variantes genéticas asociadas al riesgo cardiovascular.
Ejemplos comunes de biomarcadores incluyen los presentes en sangre, como la proteína C reactiva para la inflamación; los biomarcadores de enfermedad renal, como la creatinina; y los biomarcadores de artritis reumatoide, como los anticuerpos anti-péptido citrulinado cíclico. Más allá de las categorías tradicionales, los enfoques moleculares han introducido biomarcadores proteicos (por ejemplo, HER2 en cáncer de mama) y biomarcadores de ARN (por ejemplo, los transcritos de fusión BCR-ABL en la leucemia mieloide crónica). Estos marcadores no solo se utilizan para orientar el diagnóstico, sino también para apoyar la toma de decisiones terapéuticas y permitir el seguimiento en tiempo real de la progresión de la enfermedad.
La lista completa de biomarcadores se amplía de forma continua a medida que avanzan las tecnologías ómicas. Esta complejidad hace que la validación robusta de los métodos bioanalíticos sea esencial para garantizar la fiabilidad, reproducibilidad y conformidad regulatoria de los biomarcadores en los flujos de trabajo del desarrollo de fármacos.
Papel de los biomarcadores en la investigación traslacional y el desarrollo de fármacos
Los biomarcadores desempeñan un papel fundamental en la investigación traslacional, ya que conectan la comprensión mecanística obtenida en modelos preclínicos con los parámetros clínicos medidos en pacientes. Al traducir los cambios moleculares en resultados cuantificables, reducen la incertidumbre en el desarrollo de fármacos, aceleran las decisiones de continuar o no un proyecto (go/no-go) y aumentan la probabilidad de éxito clínico.
Sus aplicaciones abarcan todo el continuo de I+D:
- En la identificación y validación de dianas, los biomarcadores confirman que una vía molecular está implicada en la enfermedad y puede modificarse mediante una intervención terapéutica.
- Durante los estudios preclínicos, permiten medir los efectos farmacocinéticos y farmacodinámicos (PK/PD), lo que ayuda a verificar que un compuesto interactúa con su diana prevista.
- En las fases clínicas iniciales, aportan evidencia temprana de eficacia y seguridad, guiando la selección de dosis y la estratificación de pacientes.
- En los ensayos de fases avanzadas, los biomarcadores pueden actuar como parámetros subrogados, proporcionando información temprana sobre el beneficio clínico y, potencialmente, respaldando la aprobación acelerada.
La integración de biomarcadores acelera los plazos de desarrollo y reduce el riesgo de fracasos costosos en fases avanzadas, convirtiéndolos en herramientas esenciales para una innovación farmacéutica eficiente.
Métodos bioanalíticos para la detección de biomarcadores: desde el muestreo hasta la validación
La precisión de las tecnologías de detección de biomarcadores es fundamental para su utilidad en la investigación y el desarrollo clínico. Los flujos de trabajo bioanalíticos deben ser capaces de captar las señales moleculares en una amplia variedad de matrices, desde plasma y tejido hasta líquido cefalorraquídeo, manteniendo siempre la sensibilidad, la especificidad y la reproducibilidad.
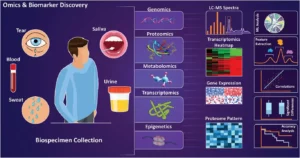
Figura 1. Análisis biocomposicional de diversas muestras biológicas.
Fuente: Haghayegh F, et al. Revolutionary Point-of-Care Wearable Diagnostics for Early Disease Detection and Biomarker Discovery through Intelligent Technologies. Adv Sci (Weinh). 2024 Sep;11(36):e2400595.
El flujo típico de análisis de biomarcadores incluye:
- Muestreo y manejo preanalítico: la correcta recogida, estabilización y conservación de las muestras biológicas es crucial para evitar la degradación o la pérdida de señal.
- Plataformas de detección: entre las técnicas se incluyen ELISA, inmunoensayos multiplex, PCR cuantitativa para ácidos nucleicos y LC-MS avanzada para el perfilado proteómico.
- Procesamiento y cuantificación de datos: las plataformas de alto rendimiento requieren herramientas informáticas robustas para la normalización de señales, calibración y control de calidad.
- Validación: seguir las guías regulatorias para la validación de métodos bioanalíticos, como las publicadas por la Administración de Alimentos y Medicamentos de EE. UU. y la Agencia Europea de Medicamentos (FDA y EMA, respectivamente, por sus siglas en inglés), garantiza la exactitud, precisión, linealidad y robustez del ensayo.
Como destacan recientes revisiones científicas, el éxito bioanalítico depende cada vez más de la integración de la automatización, la instrumentación de alta resolución y las herramientas de procesamiento digital para reducir la variabilidad y aumentar la capacidad analítica. Estos avances permiten un bioanálisis más completo de biomarcadores proteicos, biomarcadores de ARN y metabolitos, reforzando la fiabilidad de los datos de investigación traslacional.
En última instancia, un flujo de trabajo bioanalítico bien validado garantiza que las mediciones de biomarcadores tengan significado clínico. Esta alineación entre la calidad analítica y la interpretación biológica es lo que permite que los biomarcadores actúen como indicadores fiables en el desarrollo de fármacos, la evaluación regulatoria y la medicina personalizada.
Tendencias actuales en el análisis de biomarcadores: automatización, herramientas digitales y medicina personalizada
El análisis de biomarcadores está entrando en una nueva fase marcada por la automatización, la digitalización y la integración de datos. Estos avances están incrementando la precisión analítica, la escalabilidad y la relevancia clínica, especialmente en el contexto de la medicina personalizada.
La automatización sustenta hoy buena parte del bioanálisis moderno, mejorando la reproducibilidad y la capacidad de procesamiento mediante la manipulación robótica de muestras y flujos de trabajo estandarizados. Combinados con tecnologías avanzadas de detección de biomarcadores, estos sistemas permiten el análisis simultáneo de múltiples biomarcadores proteicos y de ARN, reduciendo la variabilidad y acelerando el descubrimiento.
Al mismo tiempo, la transformación digital está redefiniendo la interpretación de los datos. La inteligencia artificial y el aprendizaje automático se aplican ahora a conjuntos de datos multi-ómicos, revelando correlaciones ocultas e identificando nuevos biomarcadores predictivos y pronósticos. El auge de los biomarcadores digitales, obtenidos a partir de dispositivos portátiles y sensores móviles, amplía la monitorización de biomarcadores más allá del laboratorio, ofreciendo información fisiológica continua y en tiempo real.
En conjunto, la automatización, la IA y las tecnologías conectadas están transformando la investigación de biomarcadores en una disciplina verdaderamente traslacional. Al vincular datos analíticos de alta calidad con información individualizada del paciente, estas innovaciones están allanando el camino hacia un desarrollo más rápido, un diseño de ensayos más inteligente y terapias más precisas y centradas en el paciente.

En AMSbiopharma, ofrecemos soluciones bioanalíticas personalizadas basadas en ciencia de vanguardia y en las mejores prácticas regulatorias. Apoyamos a empresas farmacéuticas y biotecnológicas en el desarrollo de métodos, validación rigurosa y ensayos conformes, facilitando la implementación segura de programas de investigación basados en biomarcadores.
Colaborar con AMSbiopharma significa acceder a precisión, fiabilidad y una cooperación ágil, esenciales para impulsar la innovación farmacéutica.
Referencias
Califf RM. Biomarker definitions and their applications. Exp Biol Med (Maywood). 2018 Feb;243(3):213-221. doi: 10.1177/1535370217750088
Cockburn JG, Mariappan V, Loke MF, Al-Maleki AR, Muttiah B, Vellasamy KM, et al. Integrative research: Current trends and considerations for biomarker discovery and precision medicine. Microbe. 2025;7(100368):100368. doi: 10.1016/j.microb.2025.100368
European Medicines Agency. ICH M10: Bioanalytical Method Validation – Scientific Guideline [Internet]. Amsterdam (The Netherlands): EMA; [cited 2025 Oct 10]. Disponible en: https://www.ema.europa.eu/en/ich-m10-bioanalytical-method-validation-scientific-guideline
Hendrikse NM, Llinares Garcia J, Vetter T, Humphreys AJ, Ehmann F. Biomarkers in Medicines Development-From Discovery to Regulatory Qualification and Beyond. Front Med (Lausanne). 2022 Apr 26;9:878942. doi: 10.3389/fmed.2022.878942
Moein MM, El Beqqali A, Abdel-Rehim M. Bioanalytical method development and validation: Critical concepts and strategies. J Chromatogr B Analyt Technol Biomed Life Sci. 2017 Feb 1;1043:3-11. doi: 10.1016/j.jchromb.2016.09.028
U.S. Food and Drug Administration. Bioanalytical Method Validation Guidance for Industry [Internet]. Silver Spring (MD): FDA; [updated May 2018; cited 2025 Oct 10]. Disponible en: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/bioanalytical-method-validation-guidance-industry


