La semaglutida ha surgido como una terapia revolucionaria para el manejo de la diabetes tipo 2, comercializada bajo marcas como Ozempic. Como agonista del receptor del péptido similar al glucagón tipo 1 (GLP-1), ofrece beneficios significativos en la regulación de la glucosa y el control del peso.
Su patente está programada para expirar en 2026 en países como China, lo que allanará el camino para alternativas genéricas. Actualmente, al menos 15 empresas farmacéuticas chinas están desarrollando versiones genéricas, y se espera que muchas más sigan este camino a medida que expiren las patentes en todo el mundo. Esta creciente competencia subraya la importancia del estricto control de las impurezas de Ozempic para garantizar la seguridad y eficacia de estas alternativas.
¿Qué contiene Ozempic? Desglosando la composición e impurezas de la semaglutida
El principio activo de Ozempic es la semaglutida, un agonista del receptor GLP-1 de acción prolongada que activa específicamente el receptor GLP-1 (GLP-1R). La semaglutida es un péptido terapéutico producido mediante tecnología de ADN recombinante (rADN) en células de levadura modificadas genéticamente. Comparte un 94% de homología estructural con el GLP-1 nativo; sin embargo, presenta modificaciones clave para mejorar su estabilidad y eficacia.
Los primeros seis aminoácidos en el extremo N-terminal se eliminan, y la alanina en la posición 8 es reemplazada por Aib (2-aminoisobutirato) para evitar su degradación enzimática in vivo. Además, la lisina en la posición 28 se sustituye por arginina, dejando la lisina en la posición 26 disponible para la unión con una cadena tipo ácido graso/etilenglicol, lo que extiende la vida media del fármaco al unirse a la albúmina sérica. Esta modificación se añade químicamente tras la purificación del péptido obtenido por fermentación.
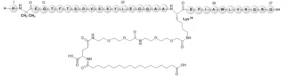
Ozempic también contiene excipientes que mejoran su estabilidad, biodisponibilidad y vida útil. Sus ingredientes inactivos incluyen fosfato disódico dihidrato (agentes tampón), propilenglicol (agentes de tonicidad), fenol (conservante), ácido clorhídrico (ajuste de pH), hidróxido de sodio (ajuste de pH) y agua para inyecciones (disolvente). Estos componentes son esenciales, especialmente considerando que la semaglutida no requiere refrigeración.
Más allá de sus ingredientes, Ozempic y otros fármacos basados en semaglutida pueden contener impurezas generadas durante la producción y el almacenamiento. Estas impurezas pueden originarse en la fermentación por el organismo hospedador, en el proceso de recuperación y purificación del precursor de semaglutida, en las modificaciones químicas y en las fases finales de purificación.
Importancia del control de impurezas en semaglutida: seguridad, eficacia y normativas regulatorias
La presencia de impurezas en cualquier fármaco plantea preocupaciones sobre la seguridad del paciente, la eficacia del medicamento y el cumplimiento normativo.
Durante el desarrollo de la semaglutida, la identificación y cuantificación de impurezas peptídicas estructuralmente similares al producto final es un paso crítico. Estas impurezas pueden deberse a cambios en la secuencia del péptido, como adiciones o deleciones no intencionadas, oxidación o conversión en isómeros de forma D. Tales alteraciones pueden generar inconsistencias en el producto final, lo que requiere una estricta supervisión para prevenir:
- Reducción de eficacia: La integridad química de la semaglutida es clave para su efectividad terapéutica. Las impurezas pueden disminuir su potencia o alterar su farmacocinética, causando variaciones en el control de la glucosa en sangre.
- Riesgos para la seguridad: Algunas impurezas pueden desencadenar respuestas inmunes adversas. Casos previos con otros agonistas peptídicos de GLP-1, como el taspoglutide, llevaron a la suspensión de ensayos clínicos debido a reacciones severas como la anafilaxia.
- Cumplimiento normativo: La FDA y la EMA han establecido límites para las impurezas peptídicas. Cualquier impureza peptídica identificada que supere el 0,5% debe someterse a evaluación de inmunogenicidad para prevenir respuestas inmunes adversas.
El papel de los métodos analíticos avanzados en la detección de impurezas en Ozempic
Las impurezas relacionadas con la semaglutida, derivadas del proceso de síntesis por tecnología rADN, como diastereoisómeros, secuencias truncadas, sustituciones de aminoácidos, oxidación y reducción, representan retos significativos en la fabricación de Ozempic. Dado que las alteraciones menores en la secuencia pueden dificultar la separación eficaz mediante cromatografía líquida de alta resolución (HPLC), métodos avanzados como HPLC acoplado a espectrometría de masas (HPLC-MS) desempeñan un papel clave en la garantía de la pureza y el cumplimiento de los estándares regulatorios globales.

En 2021, la FDA emitió directrices para las Solicitudes Abreviadas de Nuevos Medicamentos (ANDAs) sobre péptidos sintéticos altamente purificados derivados de fármacos basados en rADN, seguidas del borrador de la EMA en 2023 sobre el desarrollo y fabricación de péptidos sintéticos. Ambas normativas exigen demostrar equivalencia estructural y funcional entre las versiones genéricas y sus fármacos de referencia.
AMSbiopharma ha desarrollado un servicio de mapeo peptídico mediante UPLC-HRMS para garantizar el control de calidad y el cumplimiento normativo en el análisis de péptidos.
No dude en contactarnos si tiene alguna pregunta sobre nuestros servicios analíticos. Nuestros expertos estarán encantados de ayudarle.
Referencias
- European Medicines Agency. Ozempic: EPAR – Public assessment report [Internet]. Amsterdam: EMA; 2022 [citado 30 enero 2025]. Disponible en: https://www.ema.europa.eu/en/documents/assessment-report/ozempic-epar-public-assessment-report_en.pdf
- Kim SH, Kim SS, Kim HJ, Park EJ, Na DH. Peptide mapping analysis of synthetic semaglutide and liraglutide for generic development of drugs originating from recombinant DNA technology. J Pharm Biomed Anal. 2025 Jan 17;256:116682. doi: 10.1016/j.jpba.2025.116682
- Lee G. The battle for billions: understanding the Ozempic patent landscape. Columbia Science and Technology Law Review [Internet]. 26 noviembre 2024 [citado 30 enero 2025]. Disponible en: https://journals.library.columbia.edu/index.php/stlr/blog/view/653
- Lowe D. Compounded and counterfeit semaglutide [Internet]. Science.org; 2023 [citado 30 enero 2025]. Disponible en: https://www.science.org/content/blog-post/compounded-and-counterfeit-semaglutide
- Pradhan, R.; et al. Glucagon-Like Peptide 1 Receptor Agonists and Risk of Anaphylactic Reaction Among Patients With Type 2 Diabetes: A Multisite Population Based Cohort Study. Am. J. Epidemiol. 2022, 191(8), 1352–1367. doi: 10.1093/aje/kwac021.


